Prima di affrontare questo nuovo argomento è forse il caso di rinfrescarci la memoria con quanto detto nell’articolo precedente intitolato “Potere solvatante dell’acqua”. Abbiamo visto che la solvatazione porta alla creazione di zone che abbiamo chiamato zona “A”, in cui le molecole d’acqua si trovano direttamente a contatto col soluto “S” e dunque risultano più o meno polarizzate a seconda dell’atomo solvatato (1). Abbiamo poi definito una zona “C” occupata dall’acqua non interessata alla solvatazione e dove le molecole d’acqua si trovano legate fra loro mediante il legame idrogeno e dunque disposte in catene lineari più o meno lunghe o in catene cicliche. Infine abbiamo chiamato zona “B” la zona di interfaccia fra la zona “A” e la zona “C”, in cui le molecole d’acqua subiscono l’influenza sia da parte delle molecole della zona “A”, sia da parte di quelle imperturbate della zona “C”. Il raggio minimo della zona “B” è pari a quello della zona A (≈5 Å) mentre il suo raggio massimo è facilmente ricavabile mediante la formula:

essendo nmax il numero massimo di molecole d’acqua al disopra del quale non vi è praticamente più effetto polarizzante(2). La figura sottoriportata è una rappresentazione di queste zone che si formano nella soluzione.
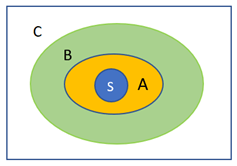
Negli articoli precedenti abbiamo analizzato con attenzione ciò che accade nella zona “A”, ora vediamo cosa accade in zona “B” tenendo conto che, in questo caso non abbiamo risultati sperimentali a conforto dei ragionamenti che ci accingiamo a fare.
Aumentando la concentrazione di un soluto può accadere che ad un certo punto il soluto cominci a precipitare oppure che la soluzione si trasformi in una forma gelatinosa a metà strada tra la forma liquida e quella solida. Dato che il volume della soluzione resta costante, all’aumentare della concentrazione di soluto aumenta il numero di zone “A” (cioè il volume occupato dalla zona “A”) e di zone “B” a discapito delle zone “C” che si riducono corrispondentemente. La presenza delle zone “C” garantisce la separazione delle zone “A” polarizzate e schermate dalle zone “B”. Nel momento in cui, all’aumentare del soluto, le zone “C” si riducono troppo, avviene quella che si chiama transizione sol-gel in cui il liquido diventa coerente. Ci sono dei casi in cui la percentuale di soluto in grado di formare il gel è minima e ciò porta ad escludere che il responsabile della formazione di gel sia la zona “A” e dunque il soluto(3). D’altro canto dobbiamo anche escludere che responsabile sia la zona “C” in quanto è costituita da acqua pura. Non ci resta che pensare alla zona “B”; l’ipotesi è che la zona di transizione “B” sia costituita da acqua “strutturata”, ossia da acqua le cui molecole sono legate fra loro in modo coerente(4). Sembra quasi che ci sia un’analogia fra acqua gelata (ghiaccio) e acqua gelatinosa (gel). Il ghiaccio è così consistente per via della struttura cristallina esagonale ben conosciuta. L’ipotesi è che con la forma gelatinosa avvenga una parziale strutturazione dell’acqua non così regolare come nel caso del ghiaccio ma tale da dare al gel una certa solidità. In effetti, nel precedente articolo “Forma polimerica dell’acqua”, abbiamo visto che le simulazioni al computer portano a molecole d’acqua legate fra loro in forma di dimeri, trimeri, tetrameri, pentameri, ed esameri in varie percentuali(5); nel momento in cui il 100% sono esameri abbiamo il ghiaccio.
Se pensiamo agli organismi viventi, essi sono costituiti da oltre il 99% di molecole d’acqua e, in generale, hanno consistenza gelatinosa. Il comportamento dell’acqua semplice è assai diverso da quello dell’acqua strutturata (gelatinosa); ad esempio, per evitare che l’acqua congeli, la rendiamo gelatinosa miscelandola con glicole etilenico, sfruttando questa proprietà nel 1930 è stato fatto uno studio che ha consentito di misurare il rapporto acqua liquida / acqua strutturata in un organismo vivente portato a -22°C(6). Si sa che al disotto di certe percentuali minime di acqua strutturata, la vita non può sussistere(7); la percentuale di acqua strutturata diminuisce man mano che si invecchia: l’uomo a livello embrionale ha la consistenza di una medusa, ma la percentuale di acqua strutturata si riduce quando diventa feto e continua progressivamente a scendere nel neonato fino a quando invecchia e muore. In certi casi la percentuale varia da stagione a stagione(8).
Con questo articolo si conclude l’approfondimento del comportamento dell’acqua mediante approccio lagrangiano. Abbiamo visto che dove c’è un atomo di ossigeno, è facile trovare due protoni che si legano con esso ed ecco perché l’acqua è così diffusa sulla terra.
Intanto occorre precisare che questo metodo non può soddisfare lo scienziato rigoroso che, se desidera può comunque attingere al metodo hamiltoniano ottenendo risultati ben più precisi. A noi qui interessava un metodo semplice che, evitando i complicati formalismi tipici della meccanica quantistica, ci consentisse di capire i meccanismi chimico-elettrici che regolano questi fenomeni a patto naturalmente di rinunciare ad un elevato grado di precisione nei risultati.
Facciamo un esempio. Se ci troviamo sulla superficie terrestre riusciamo percepire e dunque a studiare con grande facilità e precisione tutti i fenomeni che avvengono attorno a noi ma ci risulta difficile percepire ad esempio che la terra sta ruotando su se stessa (e noi con essa) ad una velocità di quasi 2.000 km/h; se, al contrario, ci troviamo in una navicella spaziale, la rotazione della terra risulta evidente mentre perdiamo di vista i singoli fenomeni che avvengono sulla crosta terrestre. Rimanendo nell’esempio, l’approccio analitico hamiltoniano ci consente di studiare con grande precisione tutti i fenomeni che accadono sulla crosta terrestre ma ci fa perdere di vista la rotazione della terra attorno a se stessa e, quand’anche ci mettessimo a studiarla analiticamente, il complesso formalismo fisico-matematico ci farebbe perdere la percezione del fenomeno. Al contrario, l’approccio globale laglangiano ci consente di vedere la rotazione della terra attorno a se stessa ma ci impedisce di vedere, se non in modo sfuocato, tutti i fenomeni che avvengono nella crosta terrestre. Fuor di metafora abbiamo anche visto che conoscendo i componenti chimici di cui è costituita una qualunque sostanza possiamo determinarne il suo comportamento termodinamico facendo semplicemente uso dell’elettronegatività degli elementi coinvolti e, con questo sistema possiamo arrivare a comprendere la struttura della molecola d’acqua, quella di una sostanza più complessa, quella di un corpo celeste e dunque quella dell’intero universo. Lo scotto da pagare è che non riusciamo ad entrare nel merito della complessità molecolare se non in modo approssimato.
Abbiamo appreso anche alcuni concetti molto importanti che andiamo a riassumere brevemente.
Innanzitutto abbiamo ritrovato nella zona “B” l’acqua strutturata o polimerica che approfondiremo ulteriormente in prossimi articoli che descrivono gli studi di G. Pollack sulla quarta fase dell’acqua.
Inoltre abbiamo ritrovato i concetti sviluppati in precedenti articoli sui vortici centripeti anti-entropici aggreganti e condensanti rispetto a quelli centrifughi entropici, disaggreganti e disperdenti. Qui è l’elettrone, con la sua elettronegatività nulla a giocare il ruolo di elemento anti-entropico, aggregante, condensante che ha il ruolo di mantenere gli atomi saldamente legati alle molecole di appartenenza. All’opposto abbiamo che il protone, con la sua elettronegatività elevatissima(9) cerca di delocalizzarsi il più possibile all’interno dell’acqua che lo contiene facendo aumentare l’elettronegatività dell’intera soluzione; il protone gioca dunque il ruolo di elemento entropico, disaggregante e disperdente.
D’altro canto, dalla chimica sappiamo anche che tutto ciò che è ricco di elettroni è basico e riducente mentre, al contrario, ciò che è povero di elettroni è acido e ossidante e noi, non a caso, abbiamo ritrovato una relazione diretta tra elettronegatività e pH. Tutto torna !!!
Torino, 16 maggio 2020
Gianfranco Pellegrini
Note
(1) In chimica questa zona di influenza del soluto è chiamata “sfera di coordinamento” ed ha un raggio medio all’incirca costante e pari a circa 5 Å).
(2) Partendo dal numero di Avogadro N = 6,02×1023 e sapendo che in base alla massa molecolare N molecole d’acqua occupano 18 cc, ogni molecola d’acqua occupa mediamente 18/N = 3,1×10-23 cc. Il volume in questione è allora pari a 3,1nmax10-23 cc, ossia una sfera di raggio pari a circa
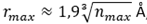
(3) Se prendiamo una medusa appena pescata che pesa 100 grammi e la facciamo evaporare, dopo l’evaporazione il peso si riduce a meno di 0,1 grammi. Questo residuo fisso pari a meno dell’1 per mille è costituito da sale da cucina e da molecole organiche (grassi, carboidrati, proteine, ecc.). Quindi una soluzione (la medusa) costituita da più del 99,9% d’acqua riesce ad avere un certo grado di solidità.
(4) E’ bene sapere che esistono transizioni sol-gel reversibili ed irreversibili; sostanze come la gelatina o l’argilla, avendo una forte carica elettrica sono reversibili, mentre il bianco d’uovo o la rigidità cadaverica, dove le molecole d’acqua in zona “B” sono soggette a legame covalente, sono esempi di transizioni irreversibili.
(5) Ad esempio a 4°C abbiamo un 40% di pentameri e un 25% di esameri che giustificherebbe il fatto che a quella temperatura la densità è massima.
(6) Praticamente si porta la sostanza organica a -20°C ; a questa temperatura si è certi che l’acqua non strutturata è tutta solidificata mentre si suppone che quella strutturata sia rimasta intatta. A questo punto la sostanza organica viene messa in un calorimetro e si determina quanto calore è necessario per il raggiungimento dell’equilibrio termico. In questo modo si può determinare la quantità di ghiaccio contenuta nel campione e, per differenza si determina la quantità di acqua strutturata. (Rif. R.A. Gortner, Trans. Farad. Soc., 26, 678 – 1930).
(7) Ad esempio, disadratando un lombrico fino al 50%, una volta reidratato riesce a sopravvivere mentre, se si supera questa percentuale muore irreversibilmente.
(8) Ad esempio per certe farfalle che vivono in luoghi con inverni rigidi, in primavera la percentuale di acqua strutturata è pari al 10% e, per contrastare le rigide temperature, in inverno sale oltre il 50%.
(9) Come abbiamo visto negli articoli precedenti, la sua elettronegatività (approssimata) è pari a EN = 4,07. Pensando alla filosofia orientale diremmo che l’elettrone è 100% “Yin” e il protone è 100% “Yang”; questo modello oltre ad un approccio pratico, ci consente anche un approccio filosofico.
